

暨南大學中藥生物技術研究所最新Nat Commun| 發掘青蒿酸生物合成二氫青蒿酸的關鍵酶
暨南大學融媒體中心訊 近日,暨南大學中藥生物技術研究所朱建華教授和于榮敏教授團隊在nature commnications期刊發表題目為“Dihydroartemisinic acid dehydrogenase-mediated alternative route for artemisinin biosynthesis”的研究成果。該研究首次報道了一種來自黃花蒿的二氫青蒿酸脫氫酶(Dihydroartemisinic acid dehydrogenase,AaDHAADH),AaDHAADH能夠催化AA和DHAA之間的雙向轉化。研究團隊通過定點誘變技術獲得了該酶的定向優化突變體(活性提高2.82倍),實現了AA到DHAA的高效轉化,并且在釀酒酵母中實現了DHAA的從頭合成,通過補料分批發酵在5 L生物反應器中實現了3.97 g/L的DHAA產量。為ART的生物合成提供了一條更加便捷、高效的生產途徑。

論文封面
背景介紹:
2006年,D.K.Ro等人首次實現工程化酵母菌株發酵生產青蒿酸(Artemisinic acid,AA)——抗瘧疾藥物青蒿素(Artemisinin,ART)的前體化合物,開啟了采用合成生物學方法生產青蒿素類化合物(Artemisinins,ARTs)的新篇章。
2013年,C.J.Paddon等人通過對ART生物合成進行工程化改造和定向整合,實現高產量AA的生產(25 g/L,5 L發酵罐)。隨后他們通過AA化學合成二氫青蒿酸(Dihydroartemisinic acid,DHAA),再經DHAA自動氧化實現半合成法生產ART。但化學合成和多步自動氧化步驟仍面臨產量損失,成本過高等問題,導致目前ART的市場來源仍然主要依賴于直接從黃花蒿植株中提取獲得。
在ART的生物合成途徑中,AA經DHAA轉化為ART是目前最優的路徑(Km,ALDH1 to AO,.58 μM,Km+EDBR2 to AO+E9 μM,代謝流傾向于生成AA),而催化AA生物合成DHAA的關鍵酶一直未被發現(圖1)。
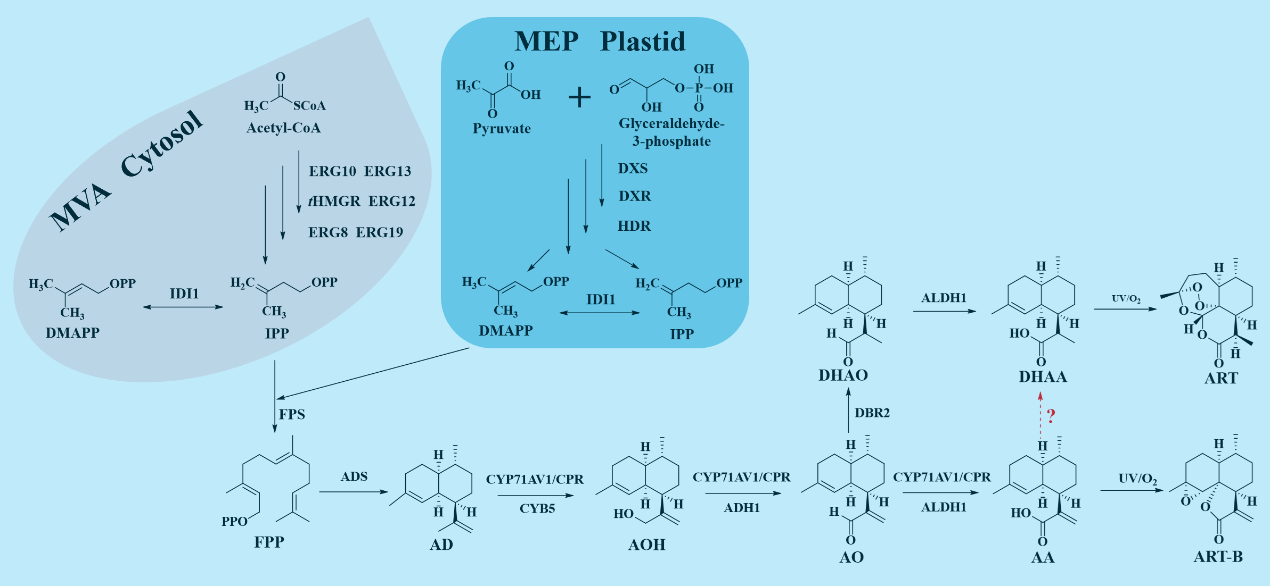
圖1 ART的生物合成途徑線路圖
研究內容簡介:
關鍵酶的挖掘和功能驗證:
本研究創新性地采用以活性導向的蛋白純化、蛋白質組學和生物信息學技術相結合的策略,成功地從復雜的植物粗酶體系中富集到目標酶,為鑒定低豐度酶和闡明未知中間產物的天然產物生物合成途徑提供了新思路。
本研究在酶功能驗證中不僅建立異源表達體系(大腸桿菌和本氏煙草),還將候選基因在內源宿主(黃花蒿細胞)中進行功能驗證,該方法更接近酶的天然催化環境,可以真實反映其生理作用,彌補了異源表達系統的不足。同時,過表達和RNAi干擾實驗的結果相互印證,進一步確證了AaDHAADH在催化AA/DHAA轉化和ART生物合成中的關鍵作用(圖2)。
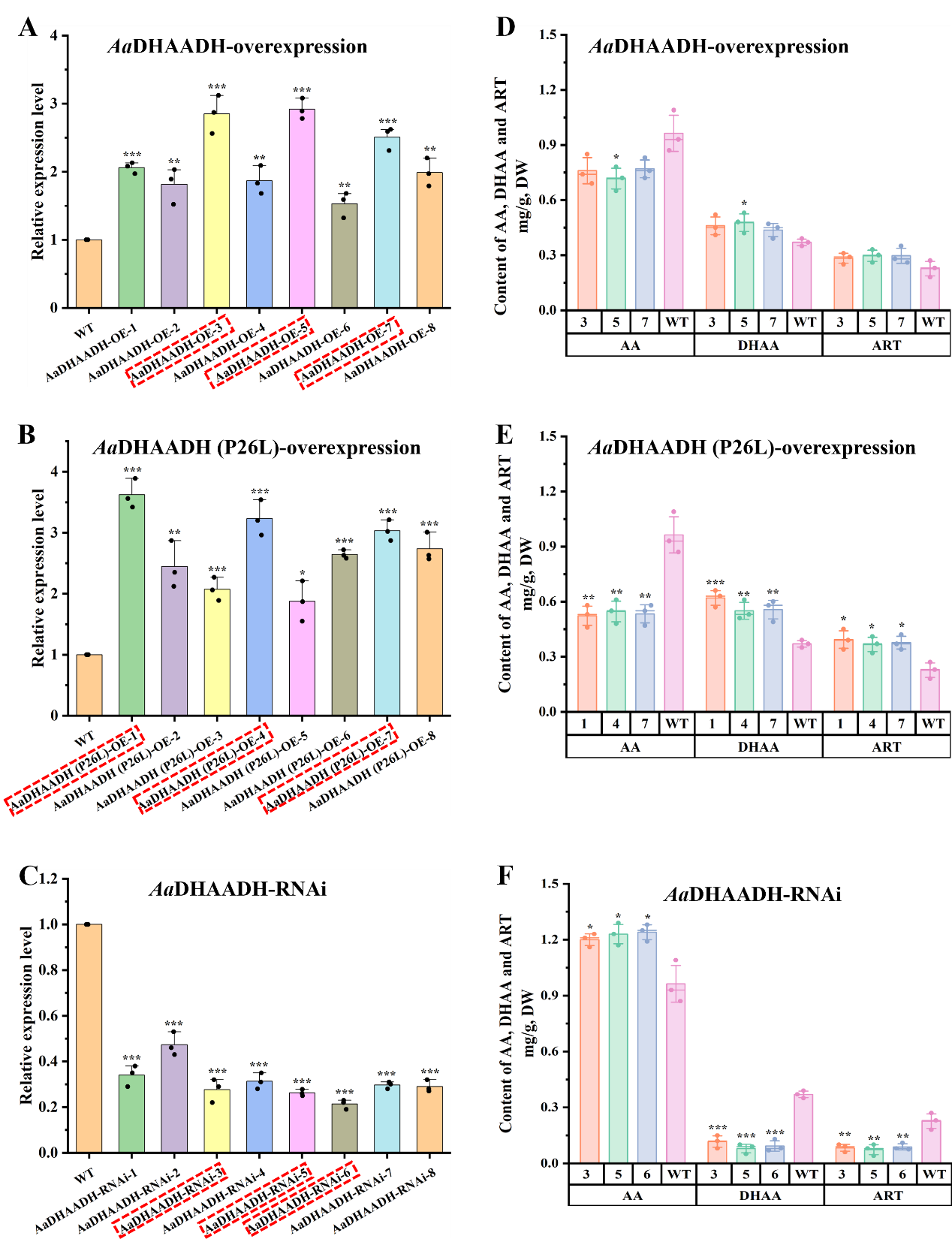
圖2 轉基因黃花蒿細胞系中AaDHAADH的相對表達情況及化合物AA、DHAA和ART的含量變化。
在釀酒酵母中從頭合成DHAA:
為了實現DHAA的發酵生產,作者通過對MVA途徑(ERG10、ERG19、IDI1、tHMG1和ERG20)和ART下游生物合成途徑中的關鍵基因(ADS、CYP71AV1、CPR、ALDH1、ADH1、CYB5和AaDHAADH(P26L))進行定向整合,得到高產DHAA的釀酒酵母底盤菌株(菌株DHAA-2)。菌株DHAA-2在250 mL搖瓶中的發酵產量為0.35 g/L,采用5 L生物反應器對菌株DHAA-2進行分批補料發酵,在216 h時DHAA的產量達到3.97 g/L(圖3)。AaDHAADH的發現,為半合成法生產ART提供了一條更加經濟、高效的DHAA來源途徑。
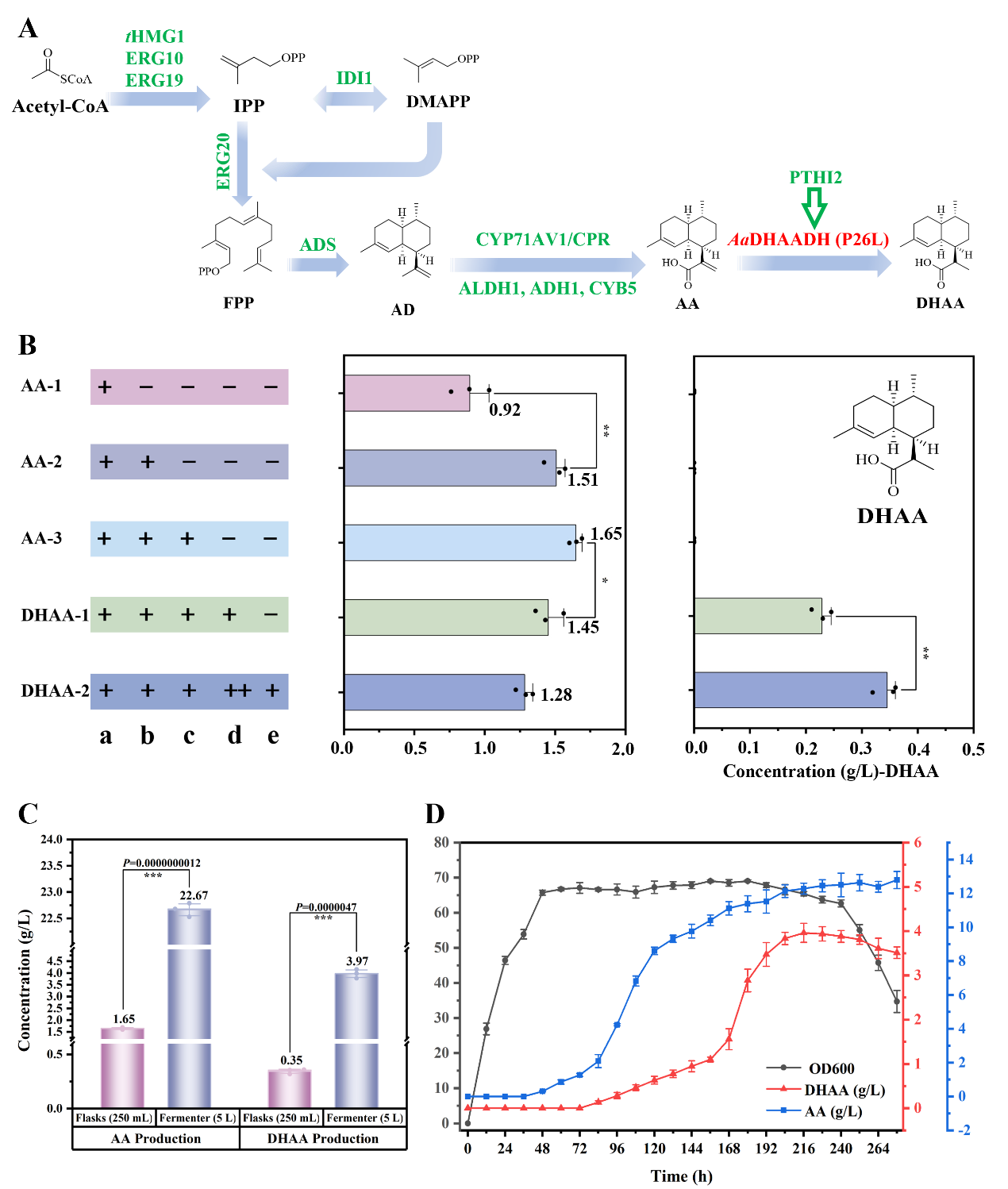
圖3 釀酒酵母中DHAA的代謝工程
A:ART生物合成途徑關鍵基因的整合;B:搖瓶發酵中AA與DHAA的產量(a:tHMG1+ERG10+ERG19+IDI1+ERG20+ADS+CYP71AV1;b:CPR+ALDH1;c:CYB5+ADH1;d:AaDHAADH(P26L);e:PTHI2);C:菌株DHAA-2與AA-3的搖瓶發酵與5 L生物反應器發酵的產量;D:菌株DHAA-2在5 L生物反應器中的生長及產量。
在本氏煙草中重構ART的生物合成途徑:
基于DHAA可以自動氧化生成ART的特性,作者通過瞬時表達ART生物合成途徑中的關鍵基因(tHMG1、ERG20、ADS、CYP71AV1、CPR、CYB5、ADH1、ALDH1和AaDHAADH(P26L)),在本氏煙草中重構ART的生物合成途徑(圖4-A)。通過在本氏煙草中共表達ADS、CYP71AV1和CPR,發現AA的產量為0.28 mg/g DW(圖4-B,D)。當引入ADH1、ALDH1和CYB5后,AA產量提升至0.62 mg/g DW(圖4-B,D)。進一步通過添加MVA途徑的關鍵基因tHMG1和ERG20優化瞬時表達系統,成功將AA產量提高至1.19 mg/g DW(圖4-B,D)。加入定向優化的活性酶AaDHAADH(P26L)后,DHAA產量達到0.51 mg/g DW(圖4-C,D),但在瞬時表達的本氏煙草中未檢測到ART。為加速DHAA自動氧化生成ART,作者對本氏煙草葉片進行紫外線照射處理,最終檢測到ART產量為0.041 mg/g DW(圖4-C,D)。
利用本氏煙草瞬時表達系統重構AA/DHAA/ART生物合成途徑,不僅證實了 AaDHAADH在異源植物體內的催化功能,也為后續工程化植物合成ART積累了重要的元件和思路,對探索ART轉運機制、提高植物合成效率具有重要意義。同時,這一研究也揭示了DHAA經自動氧化生成ART的化學轉化機制,進一步佐證了DHAA是ART生物合成的直接前體。
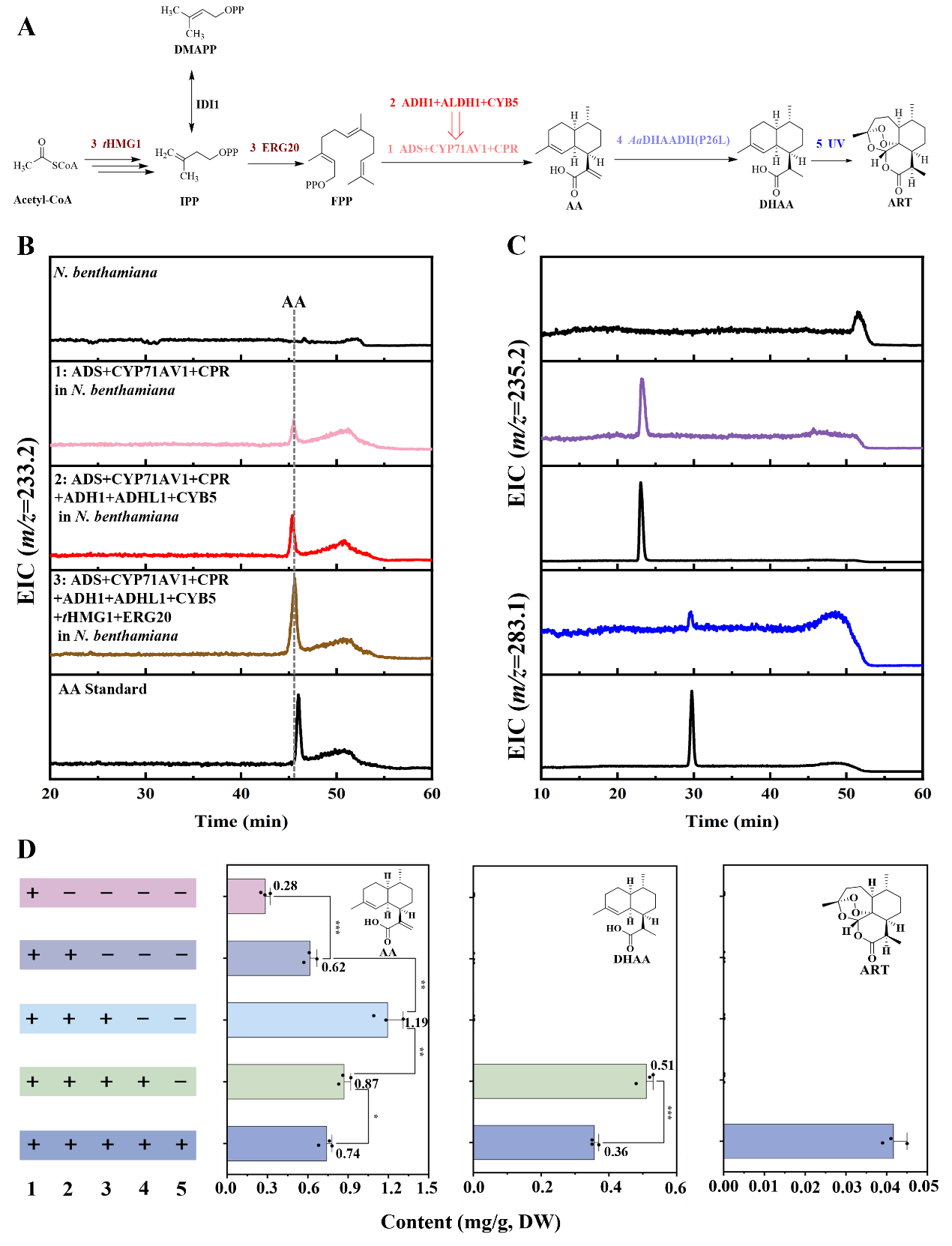
圖4 在本氏煙草中重構ART的生物合成途徑
A:在本氏煙草中ART的生物合成線路圖;B:在本氏煙草中瞬時表達關鍵酶生產AA的LC-MS檢測(m/z=233.2);C:在本氏煙草中瞬時表達關鍵酶生產DHAA(m/z=235.2)和ART(m/z=283.1)的LC-MS檢測;D:不同基因組合侵染處理的煙草葉片中產物AA、DHAA和ART的含量。
結論:
本研究在ART生物合成中成功鑒定獲得活性酶AaDHAADH,填補了AA生物合成DHAA關鍵酶的空白。同時,本研究在釀酒酵母中實現了DHAA的從頭合成,在5 L生物反應器中的產量達到3.97 g/L,展現了良好的應用前景。此外,本研究在本氏煙草中重構了ART的生物合成途徑,進一步驗證了AaDHAADH在植物體內的催化功能,也為ART的工程化植物合成提供了新的元件和思路。
論文鏈接:https://doi.org/10.1038/s41467-025-59312-1
責編:周會謙




