

暨南大學吳政/陳功教授團隊Advanced Science:腦內原位神經再生基因療法顯著改善阿爾茨海默病小鼠認知功能
暨南大學融媒體中心訊 近日,一項由暨南大學吳政/陳功教授團隊主導的研究近期在《Advanced Science》雜志上發表,該研究報道了一種全腦神經再生基因療法,能夠在阿爾茨海默病(AD)小鼠模型中顯著改善認知功能。這一突破性進展為治療阿爾茨海默病等神經退行性疾病帶來了新的希望。

阿爾茨海默病是一種進行性和不可逆的腦部疾病,全球有數千萬患者深受其苦。該疾病的病理特征包括大腦中β淀粉樣蛋白(Aβ)和tau蛋白的異常沉積,這些有毒蛋白質的積累對神經元造成不可逆的損傷。傳統上,基于清除有害蛋白的治療策略僅能部分延緩早期患者的病情進展,但無法逆轉學習記憶功能的衰退。
在這項研究中,團隊人員開發了一種創新的神經再生型基因療法,利用改造的工程化腺相關病毒載體(AAV-PHP.eb),通過系統注射的方式將神經轉錄因子NeuroD1表達在AD模型小鼠大腦星形膠質細胞中,將星形膠質細胞原位轉分化為功能性神經元。AAV-PHP.eb 血清型具有高通透血腦屏障的特性,可以實現大范圍的神經再生。研究發現,在AD小鼠模型中,原位神經再生基因療法在大腦皮層和海馬體中再生了約有50萬個新神經元,并在其他腦區也有廣泛分布。這些新生成的神經元能夠成功整合到已有的神經網絡中,顯著改善AD小鼠的認知功能。
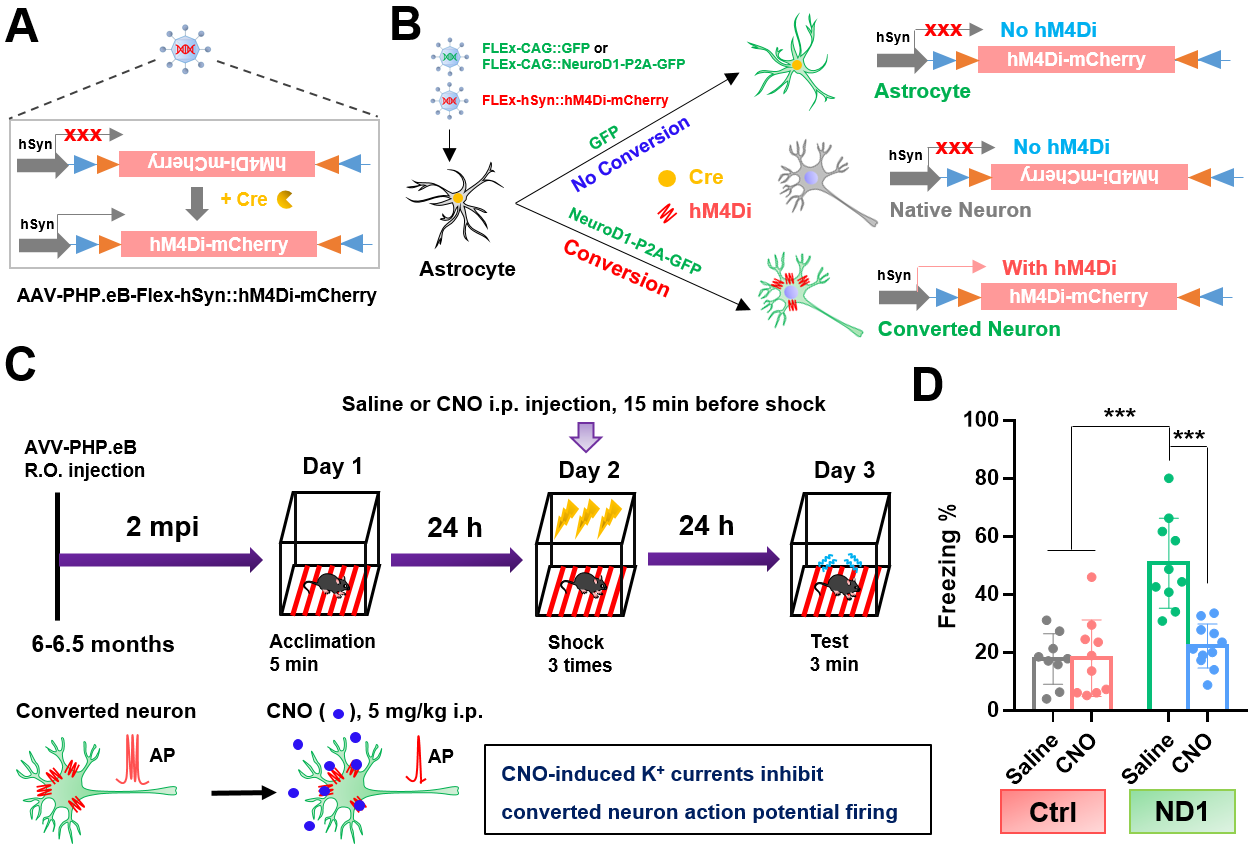
圖1 化學遺傳學證據表明原位再生神經元有助于AD小鼠恐懼記憶的改善
為了驗證新生成神經元在認知恢復中的關鍵作用,研究團隊使用了一種化學遺傳學的方法,特異性地抑制了這些新神經元的活性。結果發現,當新神經元的活性被抑制后,AD小鼠的記憶功能下降,這表明新生成的神經元對認知功能的恢復起到了至關重要的作用。
為了深入了解這種原位神經再生的分子機制,研究團隊進行了單細胞RNA測序分析。結果揭示了星形膠質細胞在轉化過程中基因轉錄組發生了顯著的變化,即從星形膠質細胞特有的基因轉錄組轉變為神經元特有的基因轉錄組。這種轉變伴隨著能量代謝方式的改變,從星形膠質細胞主要依賴的糖酵解代謝轉變為神經元偏好的氧化磷酸化代謝。單細胞測序分析發現星形膠質細胞在轉分化過程中存在多個亞群,其中第五個亞群與神經再生緊密相關。此外,研究還發現,轉化后的神經元具有與局部內源性神經元相似的分子特征和空間分布。

圖2 單細胞測序解析原位神經再生的分子機制
研究團隊還進一步探討了新生成神經元對AD小鼠大腦中Aβ病理和反應性膠質細胞的影響。結果發現,盡管新神經元的生成在短時間內并未顯著改變Aβ的沉積水平,但減少了海馬體中星形膠質細胞的應激程度和炎癥相關基因的表達,這提示神經再生基因療法也可能通過改變大腦微環境,從而有利于認知功能的恢復。這項研究不僅為阿爾茨海默病的治療提供了新的思路和方法,也為其他神經退行性疾病的治療提供了有益的借鑒。
暨南大學粵港澳中樞神經再生研究院吳政研究員與陳功教授為本文的共同通訊作者。吳政研究員和暨南大學博士研究生徐亮(已畢業)為本文的共同第一作者。研究生謝雨,紀雯宇(已畢業),李澤茹,郭耀威和李智飛副研究員也為本研究做出重要貢獻。同時本研究的前期工作也得到了賓夕法尼亞州立大學Abhijeet Sambangi,Shreya Swaminathan和Zifei Pei的大力幫助。本研究獲得了廣東省自然科學基金,廣州市重點研發計劃等基金的資助,并得到暨南大學的大力支持。
全文鏈接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202410080
責編:常凱麗




