

物理與光電工程學院關柏鷗團隊在Light: Science & Applications發(fā)表光纖腫瘤協(xié)同治療重要成果
暨南大學融媒體中心訊 近日,物理與光電工程學院關柏鷗教授團隊提出一種基于光纖的藥物遞送與光控藥物釋放策略,將藥物直接送達深部病灶,實現(xiàn)了腫瘤光熱與抗腫瘤藥物協(xié)同治療。該策略不僅提供了一種精準直接、高效能的腫瘤協(xié)同治療方法,還為藥物研發(fā)提供了一種全新高效的藥效評價與篩選平臺。研究成果以“Fiber-optic drug delivery strategy for synergistic cancer photothermal-chemotherapy”為題,于2024年9月3日發(fā)表在Light: Science & Applications(影響因子20.6)上。

傳統(tǒng)化療方式將抗腫瘤藥物通過體循環(huán)系統(tǒng)進行遞送,不僅藥物遞送效率低下,而且藥物在循環(huán)過程中不可避免地對正常器官和組織造成損害。藥物控制釋放策略可以有效地克服上述問題,因此受到了廣泛關注。其中,光熱驅(qū)動藥物釋放策略不僅能夠在對正常組織器官低損傷的情況下實現(xiàn)藥物可控性釋放,還能利用局部熱療引起腫瘤微環(huán)境變化,促進腫瘤組織對藥物的吸收,極具應用前景。然而,生物組織對光的強烈吸收與散射,使得光熱藥物釋放策略的治療深度受到了嚴重限制。此外,在治療過程中缺少溫度和藥物釋放劑量的監(jiān)控手段,也阻礙了其在藥物研究與臨床上的應用。
針對上述難題,以光纖作為藥物遞送載體,利用生物可降解的溫控相變瓊脂糖水凝膠將抗腫瘤藥物包裹于光纖表面,通過光纖介入的方法直接將藥物遞送到腫瘤病灶,在病灶處通過光纖光熱效應引發(fā)凝膠相變實現(xiàn)藥物的原位釋放,如圖1所示。該方案不僅不受光學穿透深度的限制,而且避免了傳統(tǒng)化療方式藥物經(jīng)體循環(huán)帶來的代謝損失和生物毒性。利用腫瘤組織的熱耐受能力較差以及熱刺激下微環(huán)境變化等特點,該方案對腫瘤部位的光熱效應不僅可以直接殺傷腫瘤細胞,還能增加腫瘤組織的通透性,促進腫瘤組織對藥物的吸收,巧妙地實現(xiàn)了光熱化療協(xié)同治療。
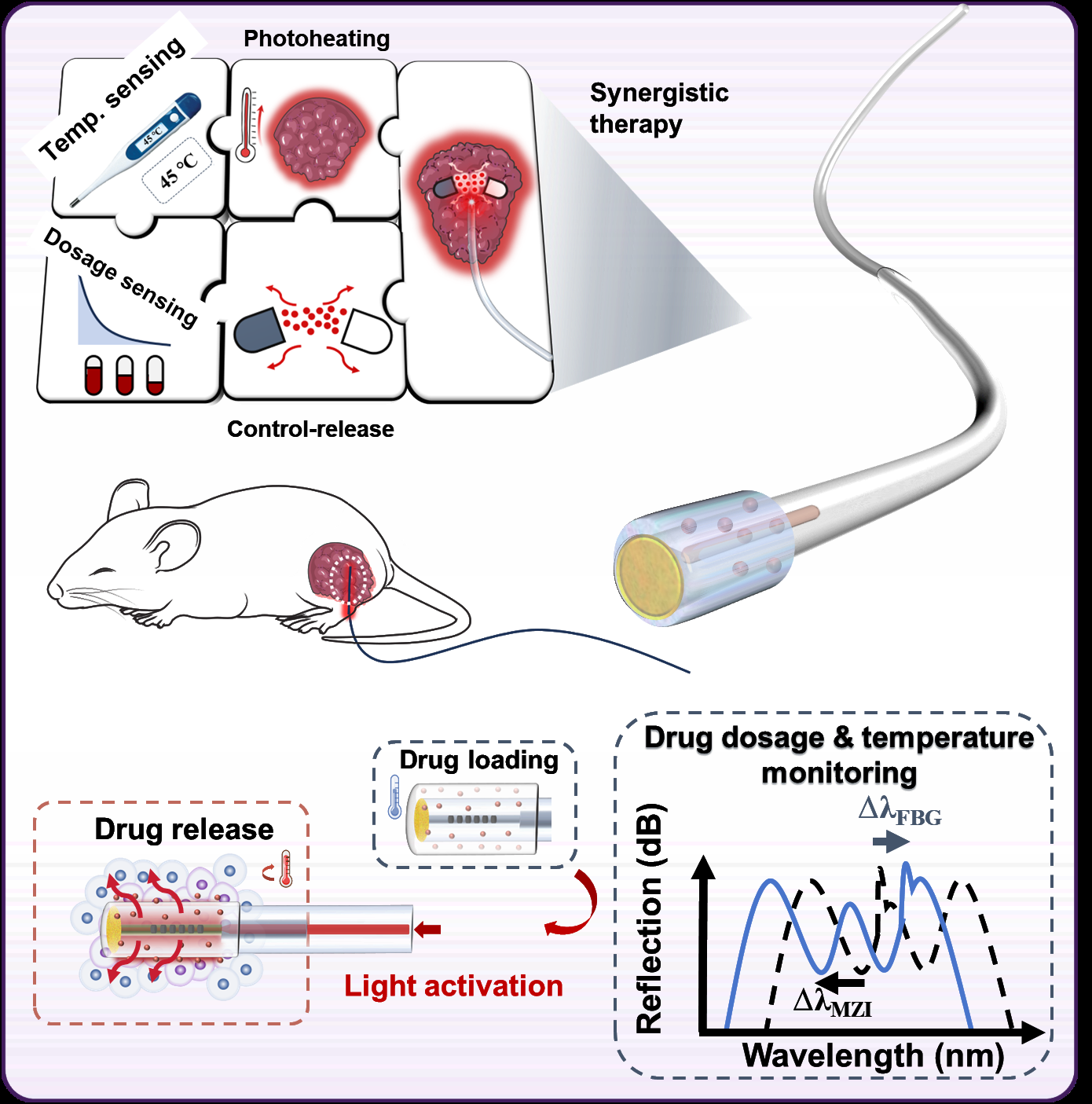
圖1 基于光纖光控藥物釋放的腫瘤光熱化療協(xié)同治療策略示意圖
如圖1所示,借助光纖豐富的設計自由度,還能夠在光纖載藥探針中集成傳感器進行溫度和藥物釋放劑量監(jiān)測,實現(xiàn)探針的多功能模塊。研究團隊利用光纖布拉格光柵(FBG)傳感器實時監(jiān)測病灶處溫度變化(圖2),利用基于反射式多模-單模光纖結(jié)構(gòu)的在線集成式馬赫-曾德干涉儀(MZI)折射率傳感器實時監(jiān)測藥物濃度劑量(圖2),實現(xiàn)了光熱藥物釋放與治療的全過程實時監(jiān)控。
由于光纖載藥探針尺寸小巧,可以深入到腫瘤中心位置進行藥物釋放,實現(xiàn)了一種全新的“中央-外周”腫瘤藥物擴散釋放機制,從而增強藥物的滲透性和滯留性,如圖2所示。此外,在治療過程中部分瓊脂糖水凝膠顆粒將會形成分散的小顆粒結(jié)構(gòu),其內(nèi)部仍然包裹著抗腫瘤藥物,這些載藥凝膠顆粒會在腫瘤患處長時間停留,并繼續(xù)通過生物降解緩釋藥物,保持治療的長期性與持續(xù)性,最終實現(xiàn)對于腫瘤細胞的全面清除。本治療探針在活體實驗中通過快速主動釋放與緩釋結(jié)合治療達到了良好的腫瘤治療效果。如圖2所示,治療組小鼠的腫瘤增長得到了很好的抑制效果,且創(chuàng)口在進行治療后21天基本恢復。
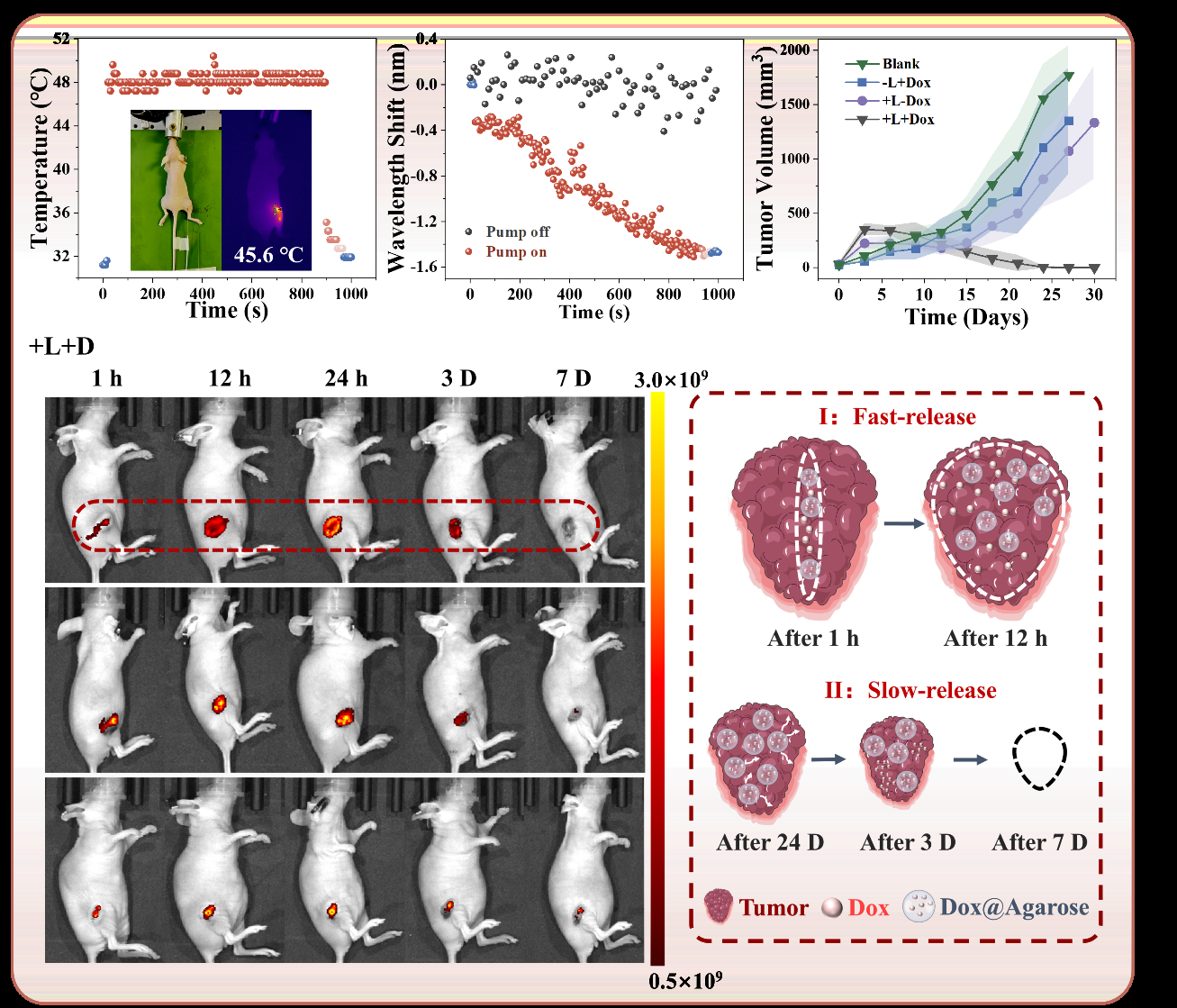
圖2基于光纖的多功能腫瘤治療探針活體實驗與治療機制探索
本治療策略在制藥領域應用上擁有巨大潛力。全球每年有超過90%的候選藥物無法通過臨床的批準。其中,由于體循環(huán)毒性以及動物模型間藥物響應差異的因素而失敗的藥物占到了三成。基于光纖的藥物遞送系統(tǒng)直接將藥物精準送達病灶,有效避開了體循環(huán)代謝系統(tǒng),能夠消除動物模型間藥物響應差異,為抗腫瘤藥物的評估與篩選提供一個全新的高效的按需給藥平臺策略,為藥物開發(fā)提供更加有效的評估手段。
該項研究由暨南大學獨立完成,碩士研究生張永康為論文第一作者,關柏鷗教授與冉洋教授為共同通訊作者,生命科學技術學院王一飛教授和鐘文彬教授、臨床醫(yī)學院李承志主任和曹東林主任做出了貢獻。該工作得到了國家自然科學基金重點項目(62335010)、“廣東特支計劃”本土創(chuàng)新創(chuàng)業(yè)團隊項目(2019BT02X105)、中央高校基本科研業(yè)務費專項資金(21623203)等項目的資助。
論文鏈接:https://doi.org/10.1038/s41377-024-01586-z
責編:蘇倩怡




